Болестта на Алцхаймер е водеща причина за деменция при възрастни хора.
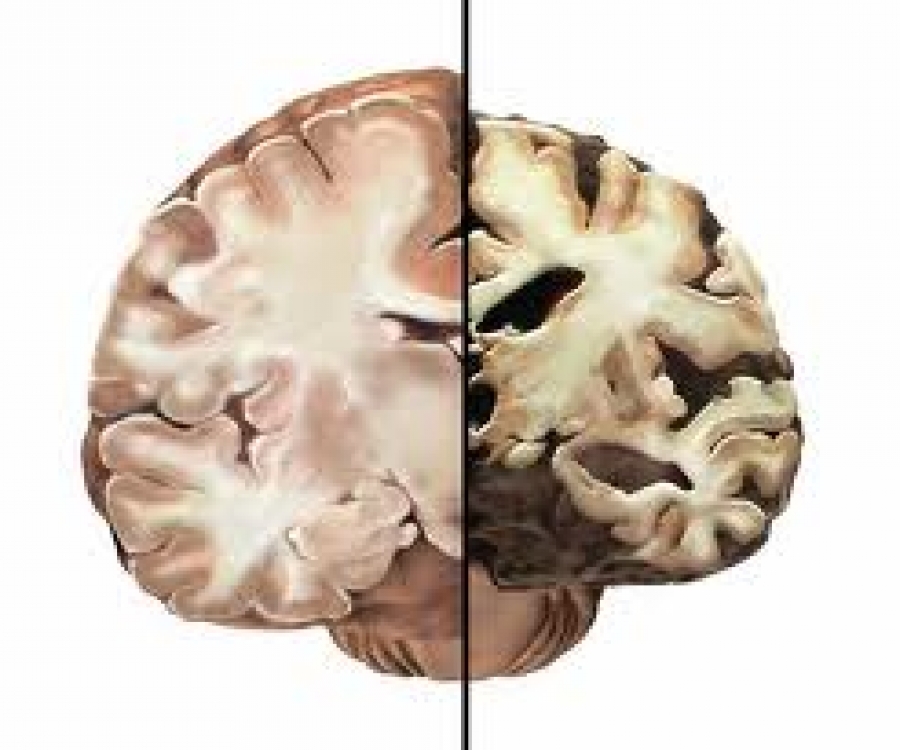
Мозък на клинически здрав човек и мозък засегнат от болестта на Алцхаймер
С нарастване на населението на планетата се очаква случаите на Алцхаймер да се утроят в следващите 50 години. Следователно, разработването на лечение, което забавя или спира развитието на заболяването, става наложително. Характерните патоанатомични увреди са мозъчна атрофия със загуба на неврони, неврофибрилна дегенерация, сенилни плаки, амилоидна ангиопатия.
Изследване, проведено в Institute for Research and Medicine, Ла Джола, Калифорния, доказва, че ТНC, активна съставка на марихуаната, инхибира ензима ацетилхолинестераза (AChE), както и предотвратява индуцираната от него агрегация на амилоид – бета- пептида, ключов патологичен маркер за Алцхаймер. В сравнение с Donepezil и Rivastigmine – лекарствата, които се изписват в момента за Алцхаймер, ТНС е значително по-добър инхибитор на агрегацията на амилоид – бета-пептида. Резултатите от изследването изясняват механизма, чрез който ТНС директно влияе на патологичните промени при Алцхаймер. ТНС и неговите аналози биха могли да осигурят по-добра терапия на болестта на Алцхаймер, като едновременно редуцират симптомите и забавят прогресията на болестта.
Как действат THC и неговите аналози?
През последните години множество проучвания показват, че ендогенните и екзогенни канабиноиди имат невропротективно действие. Механизмът, чрез който се осъществява това въздействие, все още не е съвсем ясен, но е ясно, че той включва СВ1 и СВ2 рецепторите, както и не-рецепторно медиирано антиоксидантно действие. При възпаление на ЦНС ендоканабиноидната система е силно активирана и ендоканабиноидът анандамид предпазва невроните от увреждане чрез СВ1/СВ2 медииран отговор.
Сенилните плаки са извънклетъчни лезии, съставени от агрегирани амилоид-бета-пептиди. Натрупването на тези пептиди дава началото на каскада от процеси, водещи до невронна дисфункция, невродегенерация и деменция. В изследване in vitro седоказва, че и двата ендоканабиноида – анандамид и ноладин етер, са мощни инхибитори на амилоид – бета токсичността в наномоларни концентрации. Ендоканабиноидите инхибират и производството на проинфламаторни цитокини, които доказано участват в процеса на образуване на сенилни плаки.
Голям брой изследвания показват участието на канабиноидната система в невротрансмисията, невропатологията и невробиологията на деменцията. Няколко канабиноидни субстанции демонстрират ефикасност in vivo. Литературата за използването на канабиноиди при пациенти, страдащи от Алцхаймер, обаче е оскъдна. Докато предклиничните изследвания предполагат лечение, включващо канабиноиди, клиничните изпитания се ограничават само в оценка на пригодността на агонистите/антагонистите на канабиноидните рецептори да редуцират симптомите на деменция. Необходими са по-нататъшни изследвания, включващи модели на деменция in vivo, както и повече клинични изпитания.
Клинични изследвания и доклад
Две клинични изпитания и един доклад на изолиран случай присъстват в научната литература.
При двете клинични изпитания е използван дронабиол, а при отделния случай – набилон – и двете субстанции са СВ1 и СВ2 агонисти, синтетични аналози на ТНС.
Първото е рандомизирано, двойно сляпо, плацебо контролирано, кросоувър клинично изпитание с 15 институционализирани пациенти с тежка деменция, отказващи да се хранят. Изследването е проведено в E. N. Rogers Memorial Veterans Hospital, Geriatric Research Education Clinical Center, Бедфорд, Масачузетс, САЩ. Пациентите получават 2.5 мг дронабиол в продължение на шест седмици. Телесното тегло нараства и възбудата намалява по време на изпитанието. В добавка, авторите наблюдават значително намаляване на възбудата и след приключване на опита.
Нощната възбуда и поведенческите разстройства са изследвани в отворено пилотно клинично изпитание, където се назначава 2.5 мг дронабиол в 19 часа. В изследването участват 6 пациенти с Алцхаймер. След две седмици нощната и анормална двигателна активност, нарушенията в апетита, възбудата и раздразнителността се редуцират. По време на двуседмичния изпитателен период не се наблюдават странични ефекти. Изследването е проведено в Charite Universitatsmedizin Berlin.
Набилон е използван в единичен случай на лечение на пациент с Алцхаймер, който последователно е третиран с donezepil, memantine, trazodone, quetiapine и olanzapine, без какъвто и да е ефект върху поведенческите отклонения, характерни за болестта. Пациентът е третиран с 0.5 мг набилон в продължение на седмица, след което клиницистите наблюдават драматично редуциране на възбудата и безпокойството. По време на тримесечното третиране не се наблюдават странични ефекти.